 Número atómico: 36
Número atómico: 36Grupo: 18
Periodo: 4
Configuración electrónica: [Ar] 3d10 4s2 4p6
Estados de oxidación: 0
Electronegatividad: -
Radio atómico / pm: 202
Masa atómica relativa: 83.798 ± 0.002
El criptón se aisló por primera vez en 1898 por los químicos británicos Sir William Ramsay y Morris William Travers. Su denominación proviene de la palabra griega 'kryptos', 'oculto'. Es un gas incoloro, inodoro e insípido, monoatómico como los demás gases nobles. Al igual que el neón, el criptón, se obtiene a partir del aire, en el que está presente en una relación de dilución de 1:1.000.000. La mezcla con argón se emplea en lámparas fluorescentes. Su uso más importante se encuentra en las lámparas estroboscópicas.
PROPIEDADES FISICAS
Densidad / g dm-3: 2823 (sólido, m.p.)
2413 (líquido, b.p.)
3.7493 (gaseoso, 273 K)
Volumen molar / cm3mol-1: 29.68 (sólido, m.p.)
34.73 (líquido, b.p.)
22350.84 (gaseoso, 273 K)
Resistencia eléctrica / μΩcm: - (20 °C)PROPIEDADES TÉRMICAS
Conductividad térmica / W m-1K-1: 0.0095Punto de fusión / °C: -157.36
Punto de ebullición / °C: -153.22
Calor de fusión / kJ mol-1: 1.64
Calor de vaporización / kJ mol-1: 9.05
Calor de atomización / kJ mol-1: 0
ENERGÍA DE IONIZACIÓN
Primera energía de ionización / kJ mol-1: 1350.77Segunda energía de ionización / kJ mol-1: 2350.39
Tercera energía de ionización / kJ mol-1: 3565.16
ABUNDANCIA DE ELEMENTOS
en la atmósfera / ppm: 1.14en la corteza terrestre / ppm: 0.00001
en los océanos / ppm: 0.0003
DATOS CRISTALOGRÁFICOS
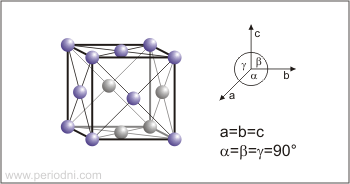 Estructura cristalina:
Estructura cristalina:
cúbica centrada en las caras
Dimensiones de la celda unidad / pm:
a=572.1
Grupo espacial:
Fm3m
ISÓTOPOS
Isótopo Masa atómica relativa Porcentaje por masa (%)
78Kr 77.920386(7) 0.35(2)
80Kr 79.916378(4) 2.25(2)
82Kr 81.913485(3) 11.6(1)
83Kr 82.914136(3) 11.5(1)
84Kr 83.911507(3) 57.0(3)
86Kr 85.910610(1) 17.3(2)
POTENCIALES ESTÁNDAR DE REDUCCIÓN
Semirreacción Eo / V
35 Bromo <= 36 Kriptón => 37 Rubidio



