 Número atómico: 29
Número atómico: 29Grupo: 11
Periodo: 4
Configuración electrónica: [Ar] 3d10 4s1
Estados de oxidación: +1 +2
Electronegatividad: 1.9
Radio atómico / pm: 127.8
Masa atómica relativa: 63.546 ± 0.003
El cobre era conocido en la prehistoria. Su nombre proviene de la isla de Chipre, donde existía en la antigüedad una gran producción de objetos de cobre. Es uno de los metales de mayor uso, de apariencia metálica y color pardo rojizo. Se encuentra en la naturaleza, principalmente, combinado con el azufre; en estado nativo se presenta con gran rareza. El cobre puro se emplea en electrotécnica debido a su alta conductividad eléctrica y térmica. Tienen gran aplicación sus aleaciones con estaño y zinc (latón, bronce).
PROPIEDADES FISICAS
Densidad / g dm-3: 8960 (293 K)
7940 (m.p.)
Volumen molar / cm3mol-1: 7.09 (293 K)
8.00 (m.p.)
Resistencia eléctrica / μΩcm: 1.673 (20 °C)PROPIEDADES TÉRMICAS
Conductividad térmica / W m-1K-1: 401Punto de fusión / °C: 1084.62
Punto de ebullición / °C: 2562
Calor de fusión / kJ mol-1: 13
Calor de vaporización / kJ mol-1: 306.7
Calor de atomización / kJ mol-1: 337.15
ENERGÍA DE IONIZACIÓN
Primera energía de ionización / kJ mol-1: 745.49Segunda energía de ionización / kJ mol-1: 1957.93
Tercera energía de ionización / kJ mol-1: 3554.64
ABUNDANCIA DE ELEMENTOS
en la atmósfera / ppm: -en la corteza terrestre / ppm: 75
en los océanos / ppm: 0.003
DATOS CRISTALOGRÁFICOS
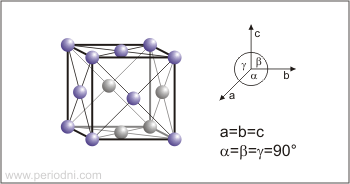 Estructura cristalina:
Estructura cristalina:
cúbica centrada en las caras
Dimensiones de la celda unidad / pm:
a=361.47
Grupo espacial:
Fm3m
ISÓTOPOS
Isótopo Masa atómica relativa Porcentaje por masa (%)
63Cu 62.929601(2) 69.17(3)
65Cu 64.927794(2) 30.83(3)
POTENCIALES ESTÁNDAR DE REDUCCIÓN
Semirreacción Eo / V
Cu2+ + 2e-  Cu(s) +0.337
Cu(s) +0.337
Cu2+ + e-  Cu+ +0.153
Cu+ +0.153
Cu+ + e-  Cu(s) +0.521
Cu(s) +0.521
HCuO2- + 3H+ + e-  Cu+ + 2H2O +1.73
Cu+ + 2H2O +1.73
CuO22- + 4H+ + e-  Cu+ + 2H2O +2.51
Cu+ + 2H2O +2.51
HCuO2- + 3H+ + 2e-  Cu(s) + 2H2O +1.13
Cu(s) + 2H2O +1.13
CuO22- + 4H+ + 2e-  Cu(s) + 2H2O +1.52
Cu(s) + 2H2O +1.52
2Cu2+ + H2O + 2e-  Cu2O(s) + 2H+ +0.20
Cu2O(s) + 2H+ +0.20
2HCuO2- + 4H+ + 2e-  Cu2O(s) + 3H2O +1.78
Cu2O(s) + 3H2O +1.78
2CuO22- + 6H+ + 2e-  Cu2O(s) + 3H2O +2.56
Cu2O(s) + 3H2O +2.56
CuO + 2H+ + e-  Cu+ + H2O +0.62
Cu+ + H2O +0.62
Cu2+ + Br- + e-  CuBr(s) +0.64
CuBr(s) +0.64
Cu2+ + Cl- + e-  CuCl(s) +0.54
CuCl(s) +0.54
Cu2+ + I- + e-  CuI(s) +0.86
CuI(s) +0.86
CuI(s) + e-  Cu(s) + I- - 0.185
Cu(s) + I- - 0.185
Cu(NH3)42+ + e-  Cu(NH3)2+ + 2NH3 - 0.01
Cu(NH3)2+ + 2NH3 - 0.01
Cu(NH3)2+ + e-  Cu(s) + 2NH3 - 0.12
Cu(s) + 2NH3 - 0.12
Cu(NH3)42+ + 2e-  Cu(s) + 4NH3 - 0.07
Cu(s) + 4NH3 - 0.07
28 Niquel <= 29 Cobre => 30 Cinc