 Número atómico: 13
Grupo: 13
Periodo: 3
Configuración electrónica: [Ne] 3s2 3p1
Estados de oxidación: +3
Electronegatividad: 1.61
Radio atómico / pm: 143.2
Masa atómica relativa: 26.9815386 ± 0.0000008
Número atómico: 13
Grupo: 13
Periodo: 3
Configuración electrónica: [Ne] 3s2 3p1
Estados de oxidación: +3
Electronegatividad: 1.61
Radio atómico / pm: 143.2
Masa atómica relativa: 26.9815386 ± 0.0000008
En 1825 el químico danés Hans Christian Oersted preparó una amalgama de aluminio (aluminio disuelto en mercurio) por reacción de cloruro de aluminio con una amalgama de potasio. Su denominación proviene de la palabra 'alumen' (alumbre). El aluminio es un metal plateado muy ligero. Al contacto con el aire se cubre rápidamente con una capa dura y transparente de óxido de aluminio que resiste la posterior acción corrosiva. El aluminio se obtiene, principalmente, a partir de la bauxita y, también, de la nefelina. Las aleaciones de aluminio se se extiende desde tubos de pasta dentífrica hasta alas de aviones.
PROPIEDADES FISICAS
Densidad / g dm-3: 2698 (293 K)
2390 (m.p.)
Volumen molar / cm3mol-1: 10.00 (293 K)
11.29 (m.p.)
Resistencia eléctrica / μΩcm: 2.65 (20 °C)
PROPIEDADES TÉRMICAS
Conductividad térmica / W m-1K-1: 237
Punto de fusión / °C: 660.32
Punto de ebullición / °C: 2519
Calor de fusión / kJ mol-1: 10.67
Calor de vaporización / kJ mol-1: 290.8
Calor de atomización / kJ mol-1: 324.01
ENERGÍA DE IONIZACIÓN
Primera energía de ionización / kJ mol-1: 577.54
Segunda energía de ionización / kJ mol-1: 1816.69
Tercera energía de ionización / kJ mol-1: 2744.80
ABUNDANCIA DE ELEMENTOS
en la atmósfera / ppm: -
en la corteza terrestre / ppm: 84100
en los océanos / ppm: 0.01
DATOS CRISTALOGRÁFICOS
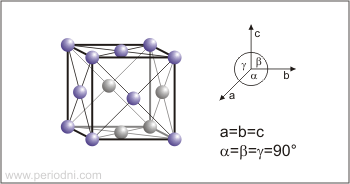 Estructura cristalina:
Estructura cristalina:
cúbica centrada en las caras
Dimensiones de la celda unidad / pm:
a=404.959
Grupo espacial:
Fm3m
ISÓTOPOS
Isótopo Masa atómica relativa Porcentaje por masa (%)
27A l26.9815384(1) 100
POTENCIALES ESTÁNDAR DE REDUCCIÓN
Semirreacción Eo / V
Al3+ + 3e-  Al(s) - 1.662
Al(s) - 1.662
Al3+ + 2e-  Al+ - 2.76
Al+ - 2.76
Al+ + e-  Al(s) - 0.55
Al(s) - 0.55
AlO2- + 4H+ + 3e-  Al(s) + 2H2O - 1.262
Al(s) + 2H2O - 1.262
Al(OH)3(s) + 3e-  Al(s) + 3OH- - 2.31
Al(s) + 3OH- - 2.31
AlF63- + 3e-  Al(s) + 6F- - 2.07
Al(s) + 6F- - 2.07
12 Magnesio <= 13 Aluminio => 14 Silicio
El Aluminio es uno de los metales más ampliamente usados y también uno de los más frecuentemente encontrados en los compuestos de la corteza terrestre. Debido a este hecho, el aluminio es comúnmente conocido como un compuesto inocente. Pero todavía, cuando uno es expuesto a altas concentraciones, este puede causar problemas de salud. La forma soluble en agua del Aluminio causa efectos perjudiciales, estas partículas son llamadas iones. Son usualmente encontradas en soluciones de Aluminio combinadas con otros iones, por ejemplo cloruro de Aluminio.
La toma de Alumino puede tener lugar a través de la comida, respirarlo y por contacto en la piel. La toma de concentraciones significantes de Aluminio puede causar un efecto serio en la salud como:
- Daño al sistema nervioso central
- Demencia
- Pérdida de la memoria
- Apatía
- Temblores severos
El Aluminio es un riesgo para ciertos ambientes de trabajo, como son las minas, donde se puede encontrar en el agua. La gente que trabaja en fabricas donde el Aluminio es aplicado durante el proceso de producción puede aumentar los problemas de pulmón cuando ellos respiran el polvo de Aluminio. El Aluminio puede causar problemas en los riñones de los pacientes, cuando entra en el cuerpo durante el proceso de diálisis.
Los efectos del Aluminio han atraido nuestra atención, mayormente debido a los problemas de acidificación. El Aluminio puede acumularse en las plantas y causar problemas de salud a animales que consumen esas plantas. Las concentraciones de Aluminio parecen ser muy altas en lagos acidificados. En estos lagos un número de peces y anfibios están disminuyendo debido a las reacciones de los iones de Aluminio con las proteinas de las agallas de los peces y los embriones de las ranas.
Elevadas concentraciones de Aluminio no sólo causan efectos sobre los peces, pero también sobre los pájaros y otros animales que consumen peces contaminados e insectos y sobre animales que respiran el Aluminio a través del aire.
Las consecuencias para los pájaros que consumen peces contaminados es que la cáscara de los huevos es más fina y los pollitos nacen con bajo peso. Las consecuencias para los animales que respiran el Aluminio a través del aire son problemas de pulmones, pérdida de peso y declinación de la actividad. Otro efecto negativo en el ambiente del Aluminio es que estos iones pueden reaccionar con los fosfatos, los cuales causan que el fosfato no esté disponible para los organismos acuáticos.
Altas concentraciones de Aluminio no sólo pueden ser encontrados en lagos ácidos y arie, también en aguas subterráneas y suelos ácidos. Hay fuertes indicadores de que el Aluminio puede dañar las raices de los árboles cuando estas están localizadas en las aguas subterráneas.
 Número atómico: 13
Número atómico: 13 Estructura cristalina:
Estructura cristalina: