 Número atómico: 20
Número atómico: 20Grupo: 2
Periodo: 4
Configuración electrónica: [Ar] 4s2
Estados de oxidación: +2
Electronegatividad: 1
Radio atómico / pm: 197.4
Masa atómica relativa: 40.078 ± 0.004
El químico británico sir Humphry Davy aisló el calcio metálico en 1808 por la electrólisis del óxido. El calcio tomó su nombre de la palabra latina calx, que designaba la cal o carbonato cálcico. Es un metal blanco, bastante duro y maleable. En aire frío y seco, el calcio no es fácilmente atacado por el oxígeno. El calcio reacciona violentamente con el agua, formando el hidróxido Ca(OH)2 y liberando hidrógeno. Se da en varios compuestos muy útiles, tales como el carbonato de calcio (CaCO3), el sulfato de calcio (CaSO4), el fluoruro de calcio (CaF2), el fosfato de calcio o roca de fosfato (Ca3(PO4)2) y varios silicatos. Se está utilizando en mayor proporción como desoxidante para cobre, níquel y acero inoxidable. El calcio, combinado químicamente, está presente en la cal (hidróxido de calcio), el cemento y el mortero, en los dientes y los huesos.
PROPIEDADES FISICAS
Densidad / g dm-3: 1550 (293 K)
1365 (m.p.)
Volumen molar / cm3mol-1: 25.86 (293 K)
29.36 (m.p.)
Resistencia eléctrica / μΩcm: 3.91 (20 °C)PROPIEDADES TÉRMICAS
Conductividad térmica / W m-1K-1: 190Punto de fusión / °C: 842
Punto de ebullición / °C: 1484
Calor de fusión / kJ mol-1: 9.33
Calor de vaporización / kJ mol-1: 150.6
Calor de atomización / kJ mol-1: 177.74
ENERGÍA DE IONIZACIÓN
Primera energía de ionización / kJ mol-1: 589.83Segunda energía de ionización / kJ mol-1: 1145.46
Tercera energía de ionización / kJ mol-1: 4912.40
ABUNDANCIA DE ELEMENTOS
en la atmósfera / ppm: -en la corteza terrestre / ppm: 52900
en los océanos / ppm: 400
DATOS CRISTALOGRÁFICOS
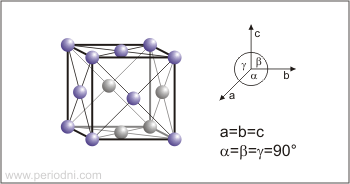 Estructura cristalina:
Estructura cristalina:
cúbica centrada en las caras
Dimensiones de la celda unidad / pm:
a=558.84
Grupo espacial:
Fm3m
ISÓTOPOS
Isótopo Masa atómica relativa Porcentaje por masa (%)
40Ca 39.9625911(3) 96.941(18)
42Ca 41.9586183(4) 0.647(9)
43Ca 42.9587668(5) 0.135(6)
44Ca 43.9554811(9) 2.086(12)
46Ca 45.953693(3) 0.004(3)
48Ca 47.952534(4) 0.187(4)
POTENCIALES ESTÁNDAR DE REDUCCIÓN
Semirreacción Eo / V
Ca2+ + 2e-  Ca(s) - 2.866
Ca(s) - 2.866
CaO + 2H+ + 2e-  Ca(s) + H2O - 1.90
Ca(s) + H2O - 1.90
Ca(OH)2(s) + 2e-  Ca(s) + 2OH- - 3.03
Ca(s) + 2OH- - 3.03
19 Potasio <= 20 Calcio => 21 Estandio