Grupo: 9
Periodo: 4
Configuración electrónica: [Ar] 3d7 4s2
Estados de oxidación: +2 +3
Electronegatividad: 1.88
Radio atómico / pm: 125.3
Masa atómica relativa: 58.933195 ± 0.000005
El cobalto fue descubierto en 1735 por el químico sueco George Brandt. Recibió su denominación de la palabra 'kobold' que significa 'duende de la montaña', 'gnomo'. Es un metal de color blanco grisáceo, muy duro, maleable, dúctil. Se utiliza para la obtención de aceros especiales, para colorear el vidrio y el esmalte de color azul, y como catalizador para obtener carburantes de la hulla. El cobalto 60 se utiliza ampliamente en la industria y en la terapia radioisotópica.
PROPIEDADES FISICAS
Densidad / g dm-3: 8900 (293 K)
7670 (m.p.)
Volumen molar / cm3mol-1: 6.62 (293 K)
7.68 (m.p.)
Resistencia eléctrica / μΩcm: 6.24 (20 °C)PROPIEDADES TÉRMICAS
Conductividad térmica / W m-1K-1: 100Punto de fusión / °C: 1495
Punto de ebullición / °C: 2927
Calor de fusión / kJ mol-1: 15.2
Calor de vaporización / kJ mol-1: 382.4
Calor de atomización / kJ mol-1: 423.082
ENERGÍA DE IONIZACIÓN
Primera energía de ionización / kJ mol-1: 760.41Segunda energía de ionización / kJ mol-1: 1648.27
Tercera energía de ionización / kJ mol-1: 3232.28
ABUNDANCIA DE ELEMENTOS
en la atmósfera / ppm: -en la corteza terrestre / ppm: 29
en los océanos / ppm: 0.0005
DATOS CRISTALOGRÁFICOS
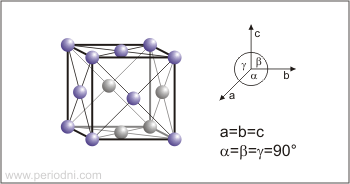 Estructura cristalina:
Estructura cristalina:
cúbica centrada en las caras
Dimensiones de la celda unidad / pm:
a=354.41
Grupo espacial:
Fm3m
ISÓTOPOS
Isótopo Masa atómica relativa Porcentaje por masa (%)
59Co 58.933200(2) 100
POTENCIALES ESTÁNDAR DE REDUCCIÓN
Semirreacción Eo / V
Co3+ + e-  Co2+ +1.808
Co2+ +1.808
Co2+ + 2e-  Co(s) - 0.277
Co(s) - 0.277
Co3O4(s) + 8H+ + 2e-  3Co2+ + 4H2O +2.11
3Co2+ + 4H2O +2.11
Co2O3(s) + 6H+ + 2e-  2Co2+ + 3H2O +1.75
2Co2+ + 3H2O +1.75
Co(OH)2(s) + 2e-  Co(s) + 2OH- - 0.73
Co(s) + 2OH- - 0.73
Co(NH3)63+ + e-  Co(NH3)62+ +0.1
Co(NH3)62+ +0.1
CoO(OH)(s) + H2O + e-  Co(OH)2(s) + OH- +0.17
Co(OH)2(s) + OH- +0.17
26Hierro <= 27 Cobalto => 28Niquel