Grupo: 18
Periodo: 6
Configuración electrónica: [Xe] 4f14 5d10 6s2 6p6
Estados de oxidación: 0
Electronegatividad: -
Radio atómico / pm: 240
Masa atómica relativa: [222]
El radón se descubrió en 1900 por el químico alemán Friedrich Ernst Dorn. Su denominación proviene de la misma raíz que la palabra 'radio'. Es un elemento gaseoso radiactivo, inodoro e incoloro, el más pesado de los gases nobles del sistema periódico. Se emplea para el tratamiento no quirúrgico del cáncer.
PROPIEDADES FISICAS
Densidad / g dm-3: 4400 (líquido, b.p.)
9.73 (gaseoso, 273 K)
Volumen molar / cm3mol-1: 50.45 (líquido, b.p.)
22816.03 (gaseoso, 273 K)
Resistencia eléctrica / μΩcm: - (20 °C)PROPIEDADES TÉRMICAS
Conductividad térmica / W m-1K-1: 0.0036Punto de fusión / °C: -71
Punto de ebullición / °C: -61.7
Calor de fusión / kJ mol-1: 2.7
Calor de vaporización / kJ mol-1: 18.1
Calor de atomización / kJ mol-1: 0
ENERGÍA DE IONIZACIÓN
Primera energía de ionización / kJ mol-1: 1037.08Segunda energía de ionización / kJ mol-1: -
Tercera energía de ionización / kJ mol-1: -
ABUNDANCIA DE ELEMENTOS
en la atmósfera / ppm: -en la corteza terrestre / ppm: -
en los océanos / ppm: 9E-15
DATOS CRISTALOGRÁFICOS
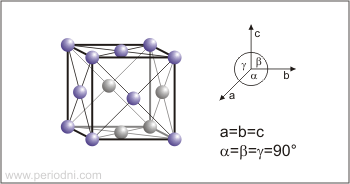 Estructura cristalina:
Estructura cristalina:
cúbica centrada en las caras
Dimensiones de la celda unidad / pm:
-
Grupo espacial:
-
ISÓTOPOS
Isótopo Masa atómica relativa Porcentaje por masa (%)
211Rn 210.990585(8) *
222Rn 222.017570(3) *
POTENCIALES ESTÁNDAR DE REDUCCIÓN
Semirreacción Eo / V
85 Astato <= 86 Radón => 87 Francio
